Research Progress on Extraction of Active Ingredients and Pretreatment of Food Analysis by Ultrasound-Assisted Deep Eutectic Solvent Method
-
摘要: 低共熔溶剂(deep eutectic solvent,DES)是由氢键受体(hydrogen-bond acceptor,HBA)与氢键供体(hydrogen-bond donor,HBD)以一定摩尔比组成的混合物。由于内部分子间氢键的相互作用使整个体系的熔点降低,并低于单个组分。它是一种无毒、廉价、制备简单和可生物降解的绿色溶剂,并且可以从不同的食品基质中萃取化学成分。目前DES与超声技术结合已经成为了食品行业新兴的萃取方式。本文简述了低共熔溶剂的分类、制备方法、超声辅助低共熔溶剂萃取过程的影响因素,并综述此方法在提取活性成分与食品分析预处理中的最新应用进展。Abstract: Deep eutectic solvent (DES) is a mixture formed by the combination of hydrogen-bond acceptor (HBA) and hydrogen-bond donor (HBD) with a certain stoichiometric ratio.The melting point of the whole system is lower than that of a single component due to the intermolecular hydrogen bond interaction. It is a non-toxic, inexpensive, easy preparation and biodegradable green solvent and can extract some chemical components from different food matrix.At present, the combination of DES and ultrasonic technology has become a new extraction tool in the food industry. This paper mainly summarizes the classification of DES, preparation method of DES and the influence of the ultrasound-assisted extraction with deep eutectic solvent. At the same time, its application in extraction of active ingredients and pretreatment of food analysis is also discussed.
-
Keywords:
- deep eutectic solvent /
- ultrasound-assisted /
- extraction /
- active ingredients /
- pretreatment /
- food
-
随着食品工业的发展,利用萃取技术从食品中提取生物活性物质以及对食品中特殊成分的预处理已经成为重要研究方法。萃取分离技术主要有传统萃取技术和现代萃取技术两种[1-2]。传统的方法包括浸渍法、渗滤法、索氏提取法和溶剂提取法。这些方法的萃取周期长、操作复杂、成本高并且回收困难。现代一些新的技术包括酶辅助萃取、超声波辅助萃取、微波辅助萃取、亚临界流体萃取、超临界萃取和高压辅助萃取。这些萃取方法一般具有萃取时间短、成本低和提取物纯度高等优点,其中超声波辅助萃取效率高、重复性好且需要的溶剂量少,在食品工业中应用最为广泛。然而这些萃取方式都采用传统有机萃取溶剂,存在着毒性问题,会对环境以及食品造成影响。
随着绿色提取概念的提出,使用高效率超声波技术结合对环境友好的萃取溶剂来进行萃取成为研究的热点。离子液体是近年来应用较多的一种高效萃取剂,它是指由有机阳离子和无机或有机阴离子构成的在室温或近于室温下呈液态的盐类[3],但其在食品领域的应用存在一定的安全问题,并不是完全的绿色溶剂。低共熔溶剂(deep eutectic solvent,DES)是一种新型的提取溶剂,是传统有机溶剂和离子液体的潜在替代品,其优点在于具有无毒性、低挥发性、高热稳定性等特点。DES可由两种或三种化合物通过形成氢键缔合形成,同时氢键作用会使体系的熔点降低,最终形成的DES熔点低于任意组分。DES的高表面张力、高密度和高极性等性质使其具有良好的溶剂特性。将低共熔溶剂进一步结合超声辅助萃取(ultrasonic assisted extraction-deep eutectic solvent,UAE-DES)技术来进行食品中活性成分的提取与食品中特定物质的分析检测预处理已经成为一种新的趋势。
本文详细阐述了低共熔溶剂的分类、制备方法以及UAE-DES的影响因素,并综述了UAE-DES萃取多糖、蛋白质、酚类化合物等大分子活性物质的及对食品中农药残留与合成食用色素预富集的研究进展,为未来食品活性物质提取与分析检测领域提供了理论基础。
1. 超声辅助低共熔溶剂萃取技术概述
1.1 低共熔溶剂的概述
1.1.1 低共熔溶剂的概念
DES最初是由Abbott等[4]提出,2003年他们发现几种季铵盐(quaternary ammonium salts,QAS)与金属氧化物以适当的摩尔比混合,可以在 100 ℃以下形成低熔点共熔体系,此体系最低熔点可以达到12 ℃且在室温下呈液态。制备DES需要两类化合物,即作为氢键受体(hydrogen-bond acceptor,HBA)和氢键供体(hydrogen-bond donor,HBD)的化合物,两种化合物通过氢键和范德华力促进混合体系形成并使体系拥有良好的溶剂特性。体系的熔点远低于其中任一组分的熔点,这是由于阴离子基团与氢键相互作用增加,导致与阳离子基团的相互作用减少,阴离子基团和阳离子基团之间的弱相互作用导致溶剂熔点降低,因此反应体系中HBD与HBA的摩尔比会决定氢键与阴离子的作用强度从而决定DES的熔点[5-6]。
1.1.2 低共熔溶剂的分类
在传统DES中常用的HBA是一些卤化盐和季铵盐以及它们的衍生物[7],HBD则是一些酰胺类化合物,如有机酸、醇和多元醇等[8]。DES的组成可以用一个通用公式简单的表示为Cat+X−zY[9],其中Cat+是铵、鏻或锍的阳离子,X−是一些卤化物阴离子,z代表与阴离子相互作用的Y分子数。一般来说DES大致分为四类。第一类是由QAS和金属卤化物形成。例如,氯铝酸盐与各种非水合金属卤化物,如氯化铁(FeCl2)、氯化银(AgCl)、氯化锂(LiCl)、氯化镉(CdCl2)、氯化铜(CuCl2)、氯化锌(ZnCl2)、和氯化锡(SnCl4)等混合[10]。第二类由QAS和水合金属卤化物形成。水合金属卤化物价格低廉,不受空气或湿气的影响,适用于大规模加工。第三类是目前研究以及在萃取食品中活性化合物与有毒物质应用最广泛的一类,由QAS和HBD形成,这种类型的DES具有溶解多种物质的能力,其中包括氯化物、过渡金属以及氧化物,并且混合形成的体系不与水反应,可生物降解[11]。第四类则是由金属卤化物和HBD形成的。具体分类见表1[12]。
当一些天然产物如活细胞中的初级代谢物(糖、糖醇、有机酸、氨基酸和胺)作为 DES 溶剂的来源时,称之为天然低共熔溶剂(natural deep eutectic solvents,NADES),一般来说,NADES 中的 HBA成分是具有生理活性的胺类化合物(氯化胆碱,乙酰胆碱,氯化铵)或氨基酸(丙氨酸、脯氨酸、甘氨酸、甜菜碱),而 HBD 中最常见的是有机酸(草酸、乳酸和苹果酸等)或碳水化合物(葡萄糖、果糖和麦芽糖等)。NADES对天然产物具高溶解能力,特别是水溶性较差的化合物、稀有水溶性代谢物和大分子物质(DNA、蛋白质、纤维素和氨基酸),除此之外NADES还可以作为食品中酶促反应和生物转化过程中的介质[13-14]。
1.1.3 制备方法
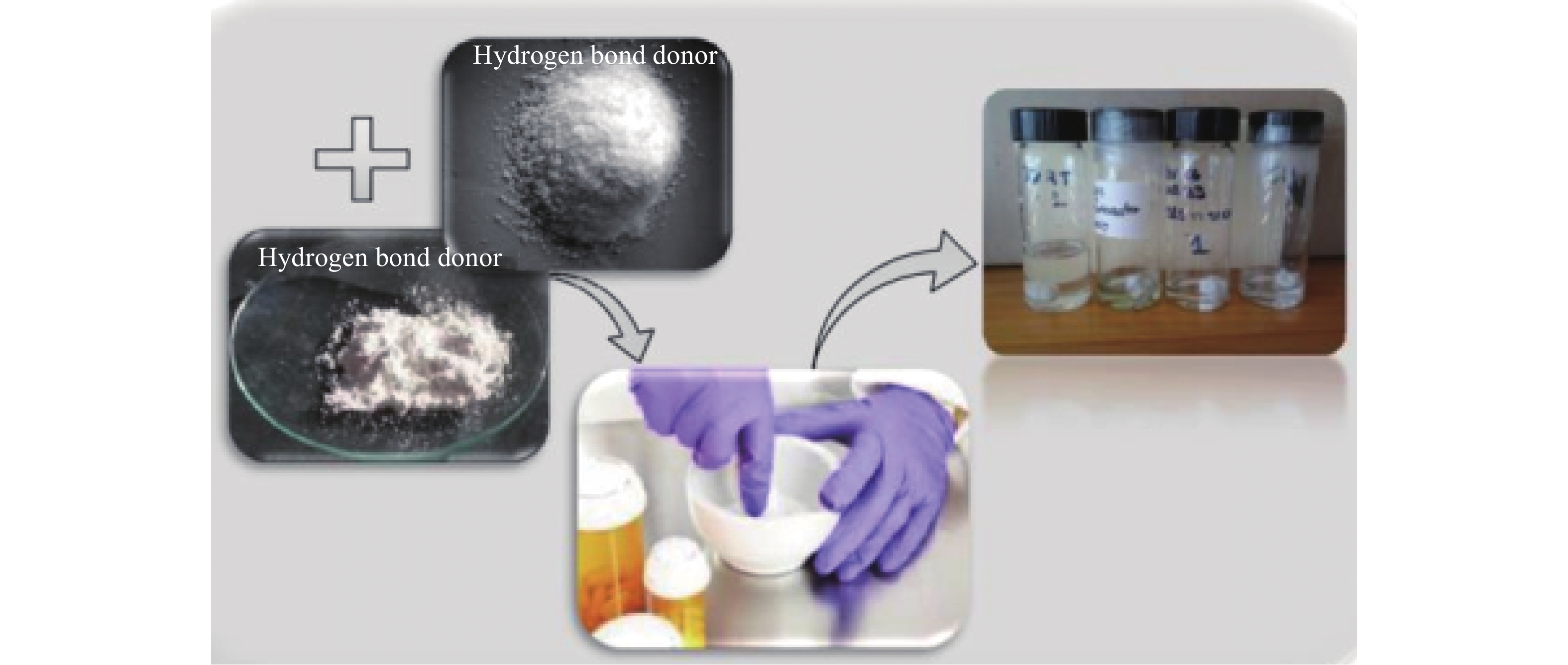
DES的制备相对简单,不同的制备方法制得的DES略有差异,最常用的方法有四种:a直接加热法:这种方法是应用最广泛的,将各组分在大约 100 ℃的温度下加热搅拌,直到形成澄清液体(约30~90 min);b研磨法:如图1所示,在室温下将各组分(可以是固固、固液、或者液液)放在研钵里充分混合,用杵研磨促进组分间反应,直到HBD与HBA反应形成氢键时,体系便形成清澈的液体[15];c真空蒸发法:有些组分自身粘度大,很难通过直接加热法获得理想的DES,可以将各组分溶解在水中以降低其粘度,用旋转蒸发器蒸发使其相互反应,将蒸发后冷却得到的液体与硅胶一同放入干燥器,直到硅胶将体系内水分完全吸收使液体达到恒重;d冷冻干燥法:将单个组分的水溶液在低温下冷冻干燥,当得到透明的粘液时停止冻干,将其进行混合得到DES[16]。这个方法可以将类似于脂质体的自组装结构纳入到体系,但在这种情况下水分会与DES相互作用,最终吸附在DES结构中成为其一部分,从而影响其部分性质[17-18]。
1.2 超声辅助低共熔溶剂萃取技术原理
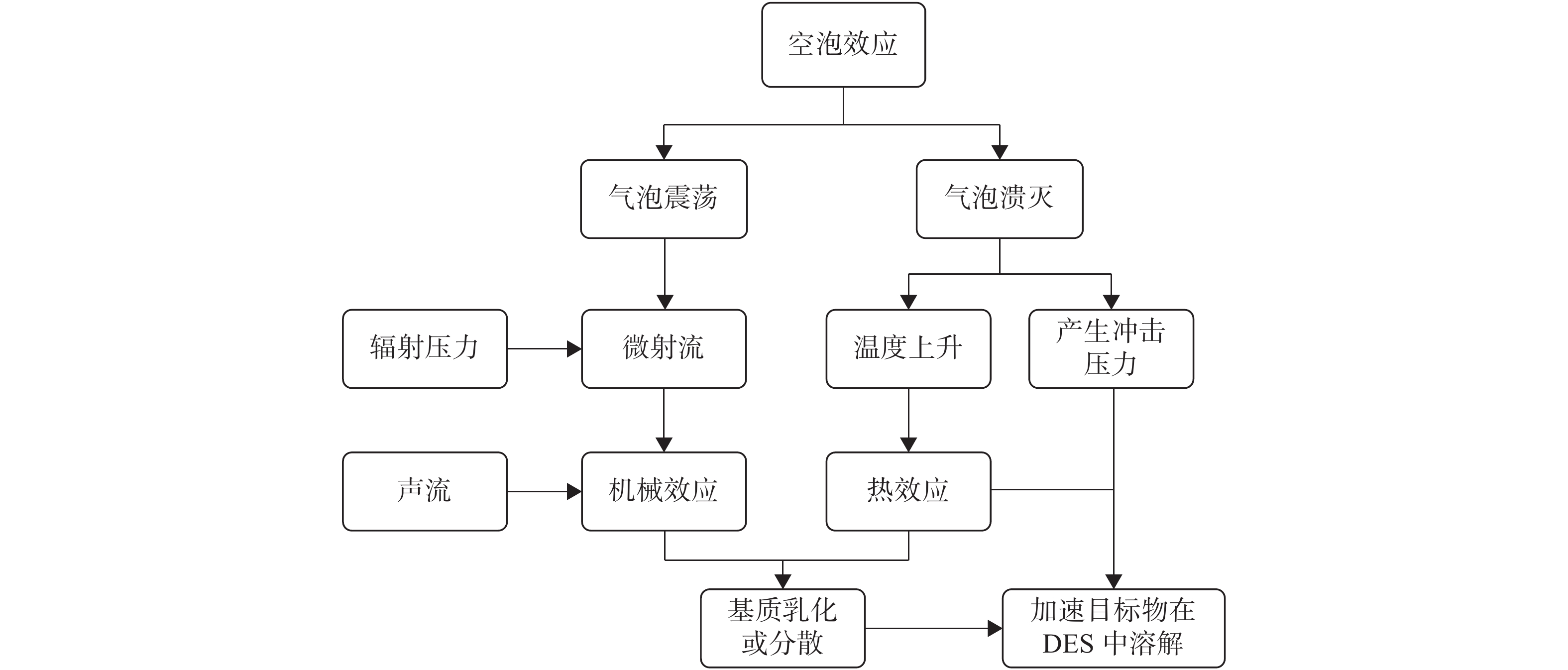
UAE-DES提高食品中目标物质的萃取率主要有两个方面原因:首先,样品与DES混合,超声波会促进样品在溶剂中的分散与渗透,增大接触面积,并且促使样品中目标物质的释放。用于萃取的超声波频率一般在20~1000 kHz,通过样品时对其连续循环的施加压缩(compression)的机械波与稀疏(rarefaction)的机械波。在对样品施加压缩波时,可促进内部分子相互碰撞,而在施加稀疏波时,会产生负压使这些分子分散。超声波在DES中传播时产生的负压会使其内部形成微小的空隙或气泡(空化泡)。这些空化泡在超声波作用下循环的进行收缩和舒张,当无法再吸收能量时就会在超声波对其施加压缩波的阶段猛烈的破裂[19],释放出大量的热量(热效应)并产生剪切力(机械效应)以及微射流,这种现象叫做空化效应。产生的热效应与机械效应会使液体乳化、固体分散并减小颗粒尺寸,机械效应与空化泡破裂产生的冲击压力一同加速目标物在DES中的的溶解,具体过程见图2;然后,由于DES极性范围广,会与目标大分子物质相互缔合,形成分子间氢键,将其固定在溶剂内部,增加溶剂中的目标物质含量,从而提高萃取率。
2. 影响UAE-DES萃取过程的因素
2.1 超声波参数对萃取过程的影响
2.1.1 超声波温度
超声波温度是影响萃取效率的关键因素,应控制在适当温度。因为在萃取过程中,温度升高会使空化效应增强,提升DES的扩散速率,使DES内部氢键相互作用减弱,粘度降低,促进DES与样品之间的混溶,提高了萃取率,但当温度接近DES的沸点时,会使其表面张力的降低,并引起蒸汽压的升高,导致更多的DES蒸汽进入起泡腔内,产生大量的空化气泡,使空化破坏强度减弱,降低超声效果[20-21],除此之外温度过高还会降低DES与目标物质之间的物理和化学吸附作用,进而使目标物在DES氢键网络中脱离并发生浸出,降低萃取率[22]。
2.1.2 超声波振幅
由于DES具有高表面张力和高粘度的物理性质,其分子内聚力大于传统有机溶剂,因此在萃取过程中要提高振幅,以增加压缩波和稀疏波循环次数,使空化效应产生足够强的负压克服DES内聚力,促进物料中目标活性物质与DES的相互作用,提高萃取率[23-24]。Hernández-Corroto等[25]发现在相同条件下超声波振幅为60%,相较于45%与30%的振幅更能促进DES与石榴皮中活性化合物的相互作用,进而取得较高的萃取量。但过高的振幅会对超声波探头磨损,引发液体翻搅并减少空化效应的产生,因此在UAE-DES过程中要适当提高超声波振幅。
2.1.3 超声时间与功率
超声时间一般从两个方面影响UAE-DES的萃取效率,首先超声波作用会促使DES形成微小的液滴,加速DES与样品间的作用,但当到达一定时间时,DES所形成的微小液滴数量达到最大值,同时UAE-DES的萃取效率达到最高,此时的超声时间为最佳[26]。其次,一些样品如黄酮类化合物,在长时间的提取下内部化学结构与会发生改变,DES与样品的相互作用变得不稳定,萃取效率降低[27],所以在UAE-DES过程中,超声时间要在一定范围内优化。此外,适当提高超声功率有助于样品在DES相中的分布,促进两者之间的传质并形成分子间氢键,提高萃取率[28]。
2.2 DES性质对萃取过程的影响
2.2.1 粘度
DES相比于其他的有机溶剂粘度较高,这归因于化合物内部氢键网络的存在,这种网络限制了DES内自由基团的流动性,导致它与其他溶液的混合性较差,这样会使萃取率降低。但DES的粘度具有可调性,通常在食品工业萃取过程中,会加入适量的水来降低DES的粘度,有研究表明在一定温度条件下加入质量分数为10%的水可以使DES体系粘度下降80%[29]。而当温度升高时,DES分子获得足够的动能来克服分子间的链段运动,导致范德华力和氢键相互作用减弱,从而具有良好的流动能力,并且DES的粘度则随着温度的升高而降低[30]。除此之外DES的粘度还可由HBD的类型、盐的类型和它们的摩尔比来调节[31]。例如,铵盐所形成的DES比鏻盐形成的DES粘度更低,并且在铵基基团内,DES的粘度随着分子量的增加而增加。所以可以通过改变这些可控因素来获得有利于萃取的DES粘度。
2.2.2 表面张力
与传统有机溶剂与离子液体相比,DES因其内部HBD的构成和强氢键结构而具有更高的表面张力,而高的表面张力有利于界面之间的传质,因此会提高萃取效率[32]。Abbot等[33]和Mjalli等[34]报道了DES的表面张力随着温度的升高而降低,因为在高温下,分子间的动能增大,内聚力减小,使得DES中的组分相互作用减弱,氢键也会发生破裂。Zhu等[35]发现萃取效率会随着HBA中烷基链长度的减少而增加,表明HBA的链长也是影响DES表面张力的重要因素。此外,Zhang等[36]发现DES组分间的摩尔比改变也会破坏体系中原有的氢键网络而影响其表面张力。
2.2.3 密度
DES的密度是决定溶剂在其它液体中扩散和混溶的一个重要性质。大多数DES的密度大于水,因此在萃取过程中便于相与相之间的分离。有研究报道了在相同温度及相同摩尔比的条件下三种DES的密度大小:DES(氯乙烯:对氯苯酚)>DES(氯乙烯:苯酚)>DES(氯乙烯:对甲酚),在实验中对氯苯酚与阴离子之间的氢键强度最强,其次是苯酚和对甲酚。表明了其密度与HBD的结构有着重要关系,HBD和阴离子之间作用越强,越会降低内部分子的迁移率,增加DES的密度[37]。此外,不同DES密度与温度会呈相应的函数关系变化,且DES密度随组成中的盐摩尔比的增加而增加[38]。所以在萃取过程中,要综合考虑HBD结构、温度和HBA与HBD的摩尔比对DES密度造成的影响。
2.2.4 pH
pH是DES溶剂性质的重要参数,当DES所处环境的pH发生改变时,会使内部HBD 或 HBA 发生浸出,从而改变 DES组成的摩尔比,对萃取过程的效率产生不利影响[35]。因此,在选择合适的萃取溶剂时,适当调整pH使HBD与HBA以最佳溶解度溶解,会更有利于萃取。
3. 超声辅助低共熔溶剂在萃取食品中活性成分中的应用
3.1 酚类化合物
酚类化合物是广泛存在于植物、水果以及其副产物中的极性生物活性物质,由一个或多个芳香环与羟基结合组成,它们具有多种有益功能包括抗氧化、抗菌、抗癌、消炎和保护神经等。但大多数酚类化合物对酸碱度较为敏感,在水溶液或传统有机溶剂中不稳定易降解,萃取率低且得到的酚类化合物抗氧化能力损失明显[39]。DES相较于传统有机溶剂极性范围广,可以与酚类化合物分子相互作用并形成分子间氢键,增加其在DES中的溶解度。这种相互作用可以将酚类化合物固定在溶剂内部结构中,降低了分子运动速率,从而避免了其在DES与空气界面处与氧气的接触而引起的氧化降解,保持稳定性与抗氧化能力[40]。Barbieri等[41]将氯化胆碱分别与甘油、草酸、乳酸和1,2-丙二醇以相应的摩尔比制成DES并加入10%水降低粘度,利用UAE-DES从迷迭香中萃取出迷迭香酸、芦丁、柚皮苷等7种酚类化合物。结果表明氯化胆碱与1,2-丙二醇组成的DES萃取得到的总酚含量最高为(62.21 ± 3.85) mg/g,而使用传统乙醇溶剂萃取得到的总酚含量仅为(49.14 ± 3.47) mg/g,此外,使用酸基DES的萃取率也较传统乙醇溶剂提高15%以上,这得益于其内部的有机酸组成增大了体系的极性强度,使其与待萃取的酚类化合物极性强度更加吻合,根据相似相容原理提高了萃取效率[42]。甘油组DES虽未有较高的萃取率,但萃取得到的酚类化合物抗氧化能力保持良好,是使用传统乙醇溶剂的两倍以上。Saha等[43]将氯化胆碱与草酸以1:1的摩尔比制成DES从一种亚热带果实Bael中成功萃取山奈酚等8种酚类化合物并进行了工艺优化,实验结果表明DES水分含量为25%、超声处理温度为80 ℃为该实验最佳萃取工艺,与常规溶剂萃取法相比,萃取率提高了60%。同样,Hsieh等[27]利用醇基DES从生姜中提取出极具热敏性的姜酚,取得较高的萃取率,但值得注意的是温度会显著影响姜粉的抗氧化能力,对此Hsieh等用响应面法确定了UAE-DES最佳提取温度34.1 ℃,时间是30 min。
3.2 黄酮类化合物
黄酮类化合物是常以自由态或结合态的形式广泛存在于植物果蔬中的一种酚类化合物衍生物,具有许多重要的生理活性,如抗氧化、抗癌、抗炎、抗菌、抗病毒、抗过敏、抗糖尿病并发症等[44]。许多黄酮化合物的水溶性较差,需要利用有机溶剂甲醇、乙醇等对其进行萃取。UAE-DES与传统溶剂萃取法相比不仅可以提高黄酮类化合物的萃取率,而且绿色环保,是一种有效的替代手段。Mansur等[45]利用UAE-DES从荞麦芽中萃取了荭草素、异荭草素、等黄酮类化合物,并将提取工艺进行了优化,实验表明与乙酰胺、尿素等组成的几组DES相比,含体积分数20%水的CCTG(氯化胆碱:三甘醇为1:4)为最佳萃取溶剂。这可能是因为本应包裹住氯离子的三甘醇中缺少HBD分支,导致氯离子与黄酮类化合物作用增强。经优化后最佳提取条件为超声40 min,温度56 ℃,与常规有机溶剂提取相比萃取率增加了3.4~5.9 mg/g。Bajkacz等[28]将氯化胆碱与柠檬酸以摩尔比为1:1制得DES,在60 ℃,超声功率为616 W的条件下从大豆产品样品中萃取异黄酮,萃取率高达64.7%~99.2%,表明了该方法是一种很有前途的富集生物活性成分的方式,可以用来提纯复杂样品中的目标化合物。Ali等[46]用此方法提高了枸杞中的类黄酮的萃取率,为从果蔬中绿色有效地提取生物活性化合物奠定了基础。值得注意的是氯化胆碱与对甲苯磺酸以1:2的摩尔比组成的DES为最佳提取溶剂,因为对甲苯磺酸是强有机酸,能改变DES的极性与亲水性,使其与黄酮类化合物之间形成更牢固的氢键。同样,孔方等[47]将氯化胆碱分别与乙二醇、丙三醇、三氟乙酸、对甲酚和三乙醇胺以摩尔比为1:2的比例制成DES从苹果叶中萃取总黄酮,实验得出氯化胆碱与三氟乙酸是最佳DES,在超声温度为72 ℃、超声时间27 min的最优工艺下总黄酮的平均萃取率达到了7.06%。
3.3 多糖
多糖是广泛存在于动、植物及果蔬中的天然高分子多聚物,具有抗氧化性、抗高胆固醇血症、抗病毒、抗肿瘤、抗糖尿病、抗炎等药用特性。最常用的多糖提取方法为水提醇沉法,将样品置于恒温热水中数个小时,然后在过滤后得到的液体中加入乙醇进行沉淀,最后蒸发掉乙醇与水得到粗多糖。这种方法耗时长,萃取率低,应用于生产中效率得不到较大提高[48]。在超声波辅助的条件下,物料基质更容易破碎从而高效、短时地释放出多糖物质,并且DES内部的结构可以与目标多糖之间形成氢键并产生静电相互作用,从而显著提高多糖的萃取率。但需要注意的是需避免为了降低DES粘度、增加其极性而加入过多的水,这会导致DES和多糖之间的相互作用减弱并形成简单水合物。此外萃取温度与时间也应该加以控制,防止多糖长时间高温萃取而发生降解。Zhang等[22]利用氯化胆碱和1,4-丁二醇组成DES,在溶剂含水量为32.89%,温度为94 ℃,超声辅助提取时间为44.74 min的最佳条件下从山药中提取出了山药多糖,平均提取率达到了15.98% ± 0.15%,相较热水提取和水基超声辅助提取有效成分的萃取率分别增加了10.51%与31.91%,研究表明了UAE-DES在萃取食品中功能性多糖方面有着巨大潜力。
3.4 蛋白质
食品中的各类蛋白质具有丰富的功能性质,越来越多的研究致力于蛋白质的纯化、分离和提取。传统的蛋白质纯化方法包括盐析、硫酸铵沉淀、离子交换等,存在成本高、产率低等缺点,并且蛋白质在有机溶剂中很容易变性。UAE-DES不仅可以有效地从物料基质中萃取蛋白质,而且DES对目标蛋白在溶剂中的溶解程度具有选择性。Li等[49]发现不同甜菜碱基DES对蛋白质的提取能力不同。例如,甜菜碱与尿素组成的DES对牛血清白蛋白的提取率最高(约90%)、甜菜碱与甲基尿素组成的DES对胰蛋白萃取率最高(约90%)、DES甜菜碱与乙二醇组成的DES对卵清蛋白萃取率最高(约60%)。表明了使用DES对蛋白质溶解性是由它们之间氢键结合、疏水相互作用和盐析效应共同决定[1]。Hernández-Corroto等[25]利用高强度聚焦超声辅助DES在石榴皮中萃取出了有效蛋白质成分,试验中氯化胆碱:乙酸:水的摩尔比为1:1:10的DES萃取效果最好,在60%的超声振幅下萃取11 min,萃取率达到(20 ± 1)mg/g(蛋白质质量/石榴皮质量),是使用传统溶剂加压液相萃取法(9.1 mg/g)的两倍以上。此外,将DES萃取得到的蛋白质与加压液相萃取法得到的相比,生物活性肽的含量高,有较强的降低胆固醇、抗氧化、抗高血压的能力,表明了UAE-DES对蛋白质分离和提取方面拥有广阔的前景。
4. 超声辅助低共熔溶剂萃取法在食品分析预处理方面的应用
4.1 农药残留的预富集
蔬菜、水果以及果汁中,常常会有农药残留,摄入后会在人体内长期停留,当积累到一定剂量时会降低人体免疫力并引发多种疾病[50]。它们会以相当低的浓度存在于复杂的食品基质中,因此在正式分析检测前需要对目标物进行预富集和纯化、消除基质干扰[51]。传统的预处理方法包括索式提取、微波辅助提取、基体固相分散等,但存在耗时、繁琐和溶剂消耗量大等缺点。UAE-DES以其短时、高效且环保等优点逐渐成为了新的替代方式,其预富集情况与部分方法的对比见表2。Heidari等[52]利用氯化胆碱与苯酚以1:2的摩尔比制成DES,并结合液-液微萃取法在pH为5.92、超声时间12.31 min的最佳萃取条件下对红葡萄汁和酸樱桃汁中残留的机磷农药与毒死蜱进行富集。结果表明,对有机磷农药与毒死蜱的检测限分别为0.070 与0.096 ng/mL,线性范围为1~500 ng/mL,平均回收率在87.3%~116.7%,与传统方法相比,某些方面具有显著优势。同样,Ji等[53]利用三辛基甲基氯化铵与辛醇制备了疏水性DES,并在超声辅助的条件下从五种饮料中萃取出磺胺类药物,最低检测限为0.02~0.05 µg/mL,线性范围在0.1~50 µg/mL,回收率高达88.09%~97.84%,表明了此方法在富集食品基质中的药物残留中有很大潜力。此外,Zhao等[54]利用UAE-DES结合功能化磁性多壁碳纳米管固相萃取法从苹果、梨、胡萝卜和黄瓜中富集了氟虫腈、甲霜灵、多效唑、腈菌唑、萘普生、噻虫啉和戊菌唑七种残留的农药,实验发现脯氨酸与丙二醇以摩尔比为1:3的比例组成的DES与几种农药间形成氢键的能力最强,萃取率最高。工艺优化后的药物检测限为0.02~0.05 μg/mL,定量限在0.05~0.10 μg/mL,平均回收率为76.09%~97.96%,表明了此法可适用于不同果蔬中农药残留的富集,是一种有前途的绿色预处理技术
表 2 超声辅助低共熔溶剂法预处理食品中农药残留与部分方法的对比Table 2. Comparison between UAE-DES and partial method for pretreatment of pesticide residues in food农药种类 方法 样品源 线性范围 检测限 平均回收率(%) 参考文献 有机磷农药 搅拌棒吸附萃取 果汁 3~1000 ng/mL 0.3 ng/mL [55] 有机溶剂微萃取 果汁 3.30~500 ng/mL 1 ng/mL [56] 多壁碳纳米管-固相萃取 水 1~500 ng/mL 0.0010 ng/mL [57] 超声辅助低共熔溶剂液-液微萃取 果汁 1~500 ng/mL 0.070 ng/mL 87.3~116.7 [52] 毒死蜱 中空纤维微孔膜液-液萃取 果汁 200~10000 ng/mL 70 ng/mL [58] 搅拌棒吸附萃取 果汁 1~1000 ng/mL 1 ng/mL [55] 气动雾化单滴微萃取 水 5~500 ng/mL 1.6 ng/mL [59] 微波辅助分散液-液微萃取 水 3~40000 ng/mL 0.74 ng/mL 82.3~98.2 [60] 有机溶剂微萃取 果汁 3.96~500 ng/mL 1.2 ng/mL [56] 多壁碳纳米管-固相萃取 水 1~500 ng/mL 0.0042 ng/mL [57] 离子液体-分散液-液微萃取 水 27.2~1089.0 ng/mL 5 ng/mL 87.3~117.6 [61] 超声辅助低共熔溶剂液-液微萃取 果汁 2~500 ng/mL 0.096 ng/mL 87.3~116.7 [52] 磺胺类农药 液相色谱-荧光法 鸡肉/鸡蛋 17.5~1000 µg/kg 4.1~25.6 µg/kg 65.9~88.1 [62] 固相萃取 蜂蜡 1~2 µg/kg 65.2~117.8 [63] 液-液萃取 鸡肉/鸡蛋 85.8~108.1 [64] 磁性固相萃取 牛奶 50~120 µg/kg 73.4~91.2 [65] 超声辅助低共熔溶剂液-液微萃取 果汁 0.1~50 µg/mL 0.02~0.05 µg/mL 88.1~97.8 [53] 4.2 合成食用色素预富集
在食品制作工艺中常常要加入一些食用色素来改善食品的感官特性,食用色素分为天然食用色素与合成食用色素。与天然食用色素相比,合成食用色素虽在食品中加入的剂量微小,但体质易过敏人群或普通人摄入超出每日安全限量可能会产生过敏、中毒等症状,甚至致癌[66]。因此必须对食品中合成食用色素的剂量进行富集、检测分析,加以把控。UAE-DES在合成色素的提取方面拥有很好的潜力。此前,Zhu等[35]已经成功将DES作为溶剂用于饮料中柠檬黄、紫红色、日落黄、靛蓝、胭脂红、诱惑红、亮蓝和赤藓红8种合成色素的富集,实验发现DES与传统溶剂相比扩散系数高,易形成浑浊液,并且有助于提高对不溶于水的色素物质萃取率。专利蓝V也是一种被广泛应用于药品、食品和饮料中合成有机偶氮食用色素,目前其每人每天允许摄入量并未有明确规定,但欧共体儿童保护集团规定不准将其用于儿童食品。因此,对食品中的专利蓝V进行富集与分析对以后的研究有着重要意义。Kanberoglu等[67]以氯化胆碱/苯酚制成DES,利用UAE-DES并结合乳化液相微萃取法从糖浆中富集专利蓝V,实验发现1:4的摩尔比萃取效率最大。这是因为苯酚中的苯环具有部分非极性特性,随着苯酚含量的增加,苯环数增多,疏水性增强,DES与专利蓝V以π-π和氢键相互作用,将其富集到DES相中。此外,乳化液的加入会减少水分子与DES作用,促进DES的自聚性与相之间的分离,优化后的专利蓝V萃取率高于92%。表明了UAE-DES准确、快速、可靠的富集合成食用色素的方法,在化合物分析检测领域有着巨大的潜力。
5. 结语与展望
UAE-DES技术与传统的萃取技术相比有许多优点,如制备简单、安全性好、绿色环保、用时短和萃取率高等,满足了现代加工对环境友好的需求。超声辅助既可以使样品基质破碎,加速目标物的溶出,又能促进DES与目标物间相互作用形成氢键,提高了萃取过程的选择性。但要注意超声温度、时间、振幅、功率对DES与目标物性质的影响,防止因DES性质发生转变与目标物的相互作用减弱或目标物分解而引起的萃取率降低的现象。然而,DES的高粘度仍是萃取过程中的缺点,今后应该更多地探究除水分与温度外降低DES粘度的方法、并明确新型HBA与HBD的选取,以将其萃取优势最大化并为活性物质的提取与食品分析预处理方面提供更多地选择。UAE-DES技术仍处于新兴阶段,仍有许多的应用领域需要探索。可将其用于固态食品中如肉制品、动物肝脏等有毒重金属的预富集,为食品安全绿色检测开辟新道路。此外,基于DES可溶解难溶性活性大分子物质并可与之相互作用的特性,未来可拓宽UAE-DES在生物催化反应以及DNA分离与稳定方面的研究。
-
DES种类 公式 示例 I Cat + X − + zMClx M (Zn, In, Sn, Al, Fe) II Cat + X − + zMClx• yH2O M (Cr, Ni, Cu, Fe, Co) III Cat+X− + zRZ Z (OH, COOH, CONH2) IV MClx + zRZ M (Zn, Al) 表 2 超声辅助低共熔溶剂法预处理食品中农药残留与部分方法的对比
Table 2 Comparison between UAE-DES and partial method for pretreatment of pesticide residues in food
农药种类 方法 样品源 线性范围 检测限 平均回收率(%) 参考文献 有机磷农药 搅拌棒吸附萃取 果汁 3~1000 ng/mL 0.3 ng/mL [55] 有机溶剂微萃取 果汁 3.30~500 ng/mL 1 ng/mL [56] 多壁碳纳米管-固相萃取 水 1~500 ng/mL 0.0010 ng/mL [57] 超声辅助低共熔溶剂液-液微萃取 果汁 1~500 ng/mL 0.070 ng/mL 87.3~116.7 [52] 毒死蜱 中空纤维微孔膜液-液萃取 果汁 200~10000 ng/mL 70 ng/mL [58] 搅拌棒吸附萃取 果汁 1~1000 ng/mL 1 ng/mL [55] 气动雾化单滴微萃取 水 5~500 ng/mL 1.6 ng/mL [59] 微波辅助分散液-液微萃取 水 3~40000 ng/mL 0.74 ng/mL 82.3~98.2 [60] 有机溶剂微萃取 果汁 3.96~500 ng/mL 1.2 ng/mL [56] 多壁碳纳米管-固相萃取 水 1~500 ng/mL 0.0042 ng/mL [57] 离子液体-分散液-液微萃取 水 27.2~1089.0 ng/mL 5 ng/mL 87.3~117.6 [61] 超声辅助低共熔溶剂液-液微萃取 果汁 2~500 ng/mL 0.096 ng/mL 87.3~116.7 [52] 磺胺类农药 液相色谱-荧光法 鸡肉/鸡蛋 17.5~1000 µg/kg 4.1~25.6 µg/kg 65.9~88.1 [62] 固相萃取 蜂蜡 1~2 µg/kg 65.2~117.8 [63] 液-液萃取 鸡肉/鸡蛋 85.8~108.1 [64] 磁性固相萃取 牛奶 50~120 µg/kg 73.4~91.2 [65] 超声辅助低共熔溶剂液-液微萃取 果汁 0.1~50 µg/mL 0.02~0.05 µg/mL 88.1~97.8 [53] -
[1] Mbous Y P, Hayyan M, Hayyan A, et al. Applications of deep eutectic solvents in biotechnology and bioengineering—promises and challenges[J]. Biotechnology Advances,2017,35(2):105−134. doi: 10.1016/j.biotechadv.2016.11.006
[2] Ventura S P M, Silva F A E, Quental M V, et al. Ionic-liquid-mediated extraction and separation processes for bioactive compounds: Past, present, and future trends[J]. Chemical Reviews,2017,111(10):6984−7052.
[3] 王丽, 刘红芝, 刘丽, 等. 离子液体在食品加工领域中应用研究进展[J]. 食品研究与开发,2017,38(14):200−204. doi: 10.3969/j.issn.1005-6521.2017.14.043 [4] Abbott A P, Capper G, Davies D L, et al. Preparation of novel, moisture-stable, Lewis-acidic ionic liquids containing quaternary ammonium salts with functional side chains[J]. Chemical Communications,2001(19):2010−2011. doi: 10.1039/b106357j
[5] Tang B, Zhang H, Row K H. Application of deep eutectic solvents in the extraction and separation of target compounds from various samples[J]. Journal of Separation Science,2015,38(6):1053−1064. doi: 10.1002/jssc.201401347
[6] Kareem M A, Mjalli F S, Hashim M A, et al. Phosphonium-based ionic liquids analogues and their physical properties[J]. Journal of Chemical & Engineering Data,2010,55(11):4632−4637.
[7] Perna F M, Vitale P, Capriati V. Deep eutectic solvents and their applications as green solvents[J]. Current Opinion in Green and Sustainable Chemistry,2020,21:27−33. doi: 10.1016/j.cogsc.2019.09.004
[8] Alkhatib I I I, Bahamon D, Llovell F, et al. Perspectives and guidelines on thermodynamic modelling of deep eutectic solvents[J]. Journal of Molecular Liquids,2020,298:112183. doi: 10.1016/j.molliq.2019.112183
[9] Chandran D, Khalid M, Walvekar R, et al. Deep eutectic solvents for extraction-desulphurization: A review[J]. Journal of Molecular Liquids,2019,275:312−322. doi: 10.1016/j.molliq.2018.11.051
[10] Sitze M S, Schreiter E R, Patterson E V, et al. Ionic liquids based on FeCl3 and FeCl2. raman scattering and ab initio calculations[J]. Inorganic Chemistry,2001,40(10):2298−2304. doi: 10.1021/ic001042r
[11] María F, Bruinhorst A V D, Kroon M C. New natural and renewable low transition temperature mixtures (LTTMs): Screening as solvents for lignocellulosic biomass processing[J]. Green Chemistry,2012,14:2153−2157. doi: 10.1039/c2gc35660k
[12] Smith E L, Abbott A P, Ryder K S. Deep eutectic solvents (DESs) and their applications[J]. Chemical Reviews,2014,114(21):11060−11082. doi: 10.1021/cr300162p
[13] Zhao H, Baker G A, Holmes S. New eutectic ionic liquids for lipase activation and enzymatic preparation of biodiesel[J]. Organic & Biomolecular Chemistry,2011,9(6):1908.
[14] Gutiérrez M C, Rubio F, Delmonte F. Resorcinol-formaldehyde polycondensation in deep eutectic solvents for the preparation of carbons and carbon-carbon nanotube composites[J]. Chemistry of Materials,2010,22(9):2711−2719. doi: 10.1021/cm9023502
[15] Florindo C, Oliveira F S, Rebelo L P N, et al. Insights into the synthesis and properties of deep eutectic solvents based on cholinium chloride and carboxylic acids[J]. ACS Sustainable Chemistry & Engineering,2014,2(10):2416−2425.
[16] Gutiérrez M C, Ferrer M L, Mateo C R, et al. Freeze-drying of aqueous solutions of deep eutectic solvents: A suitable approach to deep eutectic suspensions of self-assembled structures[J]. Langmuir,2009,25(10):5509−5515. doi: 10.1021/la900552b
[17] DaI Y, Van S J, Witkamp G J, et al. Natural deep eutectic solvents as new potential media for green technology[J]. Analytica Chimica Acta,2013,766:61−68. doi: 10.1016/j.aca.2012.12.019
[18] Choi Y H, Spronsen J V, Dai Y T, et al. Are natural deep eutectic solvents the missing link in un-derstanding cellular metabolism and physiology?[J]. Plant Physiol,2011,156(4):1701−1705. doi: 10.1104/pp.111.178426
[19] 刘远方, 李萌萌, 刘远晓, 等. 功率超声波及其在食品工业中的降解应用研究进展[J]. 食品与发酵工业,2018,44(10):287−293. [20] Esclapez M D, García-pérez J V, Mulet A, et al. Ultrasound-assisted extraction of natural products[J]. Food Engineering Reviews,2011,3(2):108−120. doi: 10.1007/s12393-011-9036-6
[21] Zhang Z S, Wang L J, LI D, et al. Ultrasound-assisted extraction of oil from flaxseed[J]. Separation and Purification Technology,2008,62(1):192−198. doi: 10.1016/j.seppur.2008.01.014
[22] Zhang L J, Wang M S. Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita Thunb[J]. International Journal of Biological Macromolecules,2017,95:675−681. doi: 10.1016/j.ijbiomac.2016.11.096
[23] Al-dhabI N A, Ponmurugan K, Maran P. Development and validation of ultrasound-assisted solid-liquid extraction of phenolic compounds from waste spent coffee grounds[J]. Ultrasonics Sonochemistry,2017,34:206−213. doi: 10.1016/j.ultsonch.2016.05.005
[24] Santos H M, Lodeiro C, Capelo-Martínez J L. José-Luis Capelo-Martínez (Ed.): Ultrasound in chemistry. Analytical applications[J]. Analytical and Bioanalytical Chemistry,2009,395(3):543−544. doi: 10.1007/s00216-009-2973-8
[25] Hernández-Corroto E, Plaza M, Marina L M, et al. Sustainable extraction of proteins and bioactive substances from pomegranate peel (Punica granatum L.) using pressurized liquids and deep eutectic solvents[J]. Innovative Food Science & Emerging Technologies,2020,60:102314.
[26] Liu X Y, Liu C R, Qian H, et al. Ultrasound-assisted dispersive liquid-liquid microextraction based on a hydrophobic deep eutectic solvent for the preconcentration of pyrethroid insecticides prior to determination by high-performance liquid chromatography[J]. Microchemical Journal,2019,146:614−621. doi: 10.1016/j.microc.2019.01.048
[27] Hsieh Y H, Li Y B, Pan Z C, et al. Ultrasonication-assisted synthesis of alcohol-based deep eutectic solvents for extraction of active compounds from ginger[J]. Ultrasonics Sonochemistry,2020,63:104915. doi: 10.1016/j.ultsonch.2019.104915
[28] Bajkacz S, Adamek J. Evaluation of new natural deep eutectic solvents for the extraction of isoflavones from soy products[J]. Talanta,2017,168:329−335. doi: 10.1016/j.talanta.2017.02.065
[29] Shah D, Mjalli F S. Effect of water on the thermo-physical properties of reline: an experimental and molecular simulation based approach[J]. Physical Chemistry Chemical Physics,2014,16(43):23900−23907. doi: 10.1039/C4CP02600D
[30] Alomar M K, Hayyan M, Alsaadi M A, et al. Glycerol-based deep eutectic solvents: Physical properties[J]. Journal of Molecular Liquids,2016,215:98−103. doi: 10.1016/j.molliq.2015.11.032
[31] Yadav A, Trivedi S, Rai R, et al. Densities and dynamic viscosities of (choline chloride+glycerol) deep eutectic solvent and its aqueous mixtures in the temperature range (283.15–363.15)K[J]. Fluid Phase Equilibria,2014,367:135−142. doi: 10.1016/j.fluid.2014.01.028
[32] Abbott A P, Barron J C, Frisch G, et al. Double layer effects on metal nucleation in deep eutectic solvents[J]. Physical Chemistry Chemical Physics,2011,13(21):10224−10231. doi: 10.1039/c0cp02244f
[33] Abbott A P, Harris R C, Ryder K S, et al. Glycerol eutectics as sustainable solvent systems[J]. Green Chemistry,2011,13:82−90. doi: 10.1039/C0GC00395F
[34] Mjalli F M, Naser J, Jibril B, et al. Tetrabutylammonium chloride based ionic liquid analogues and their physical properties[J]. Journal of Molecular Liquids,2017,241:500−510. doi: 10.1016/j.molliq.2017.06.024
[35] Zhu S, Zhou J, Jia H, et al. Liquid–liquid microextraction of synthetic pigments in beverages using a hydrophobic deep eutectic solvent[J]. Food Chemistry,2018,243:351−356. doi: 10.1016/j.foodchem.2017.09.141
[36] Zhang Q, Karine D O V, Royer Sébastien, et al. Deep eutectic solvents: syntheses, properties and applications[J]. Chemical Society Reviews,2012,41(21):7108. doi: 10.1039/c2cs35178a
[37] Zhu J H, Yu K K, Zhu Y G, et al. Physicochemical properties of deep eutectic solvents formed by choline chloride and phenolic compounds at T=(293.15 to 333.15)K: The influence of electronic effect of substitution group[J]. Journal of Molecular Liquids,2017,232:182−187. doi: 10.1016/j.molliq.2017.02.071
[38] Hayyan A, MjalliF S, AlNashef I M, et al. Fruit sugar-based deep eutectic solvents and their physical properties[J]. Thermochim Acta,2012,541:70e75.
[39] Amodio M L, Derossi A, Colelli G. Modelling sensorial and nutritional changes to better define quality and shelf life of fresh-cut melons[J]. Journal of Agricultural Engineering,2013,43:1−6. doi: 10.4081/jae.2013.e1
[40] Dai Y, Rozema E, Verpoorte R, et al. Application of natural deep eutectic solvents to the extraction of anthocyanins from Catharanthus roseus with high extractability and stability replacing conventional organic solvents[J]. Journal of Chromatography A,2016,1434:50−56. doi: 10.1016/j.chroma.2016.01.037
[41] Barbieri J B, Goltz C, Cavalheiro F B, et al. Deep eutectic solvents applied in the extraction and stabilization of rosemary (Rosmarinus officinalis L.) phenolic compounds[J]. Industrial Crops and Products,2020,144:112049. doi: 10.1016/j.indcrop.2019.112049
[42] Wu L F, Li L, Chen S J, et al. Deep eutectic solvent-based ultrasonic-assisted extraction of phenolic compounds from Moringa oleifera L. leaves: Optimization, comparison and antioxidant activity[J]. Separation and Purification Technology,2020,247:117014. doi: 10.1016/j.seppur.2020.117014
[43] Saha S K, Dey S, Chakraborty R. Effect of choline chloride-oxalic acid based deep eutectic solvent on the ultrasonic assisted extraction of polyphenols from Aegle marmelos[J]. Journal of Molecular Liquids,2019,287:110956. doi: 10.1016/j.molliq.2019.110956
[44] 钟建青, 李波, 贾琦, 等. 天然黄酮类化合物及其衍生物的构效关系研究进展[J]. 药学学报,2011,46(6):622−630. [45] Mansur A R, Song N, Jang H W, et al. Optimizing the ultrasound-assisted deep eutectic solvent extraction of flavonoids in common buckwheat sprouts[J]. Food Chemistry,2019,293:438−445. doi: 10.1016/j.foodchem.2019.05.003
[46] Ali M C, Chen J, Zhang H J, et al. Effective extraction of flavonoids from Lycium barbarum L. fruits by deep eutectic solvents-based ultrasound-assisted extraction[J]. Talanta,2019,203:16−22. doi: 10.1016/j.talanta.2019.05.012
[47] 孔方, 李莉, 刘言娟. 超声辅助低共熔溶剂提取苹果叶中的总黄酮[J/OL]. 食品工业科技: 1-15[2020-05-20]. http://kns.cnki.net/kcms/detail/11.1759.TS.20200311.1847.015.html. [48] 张梓原, 徐伟, 王鑫, 等. 黄精多糖的提取工艺对比研究[J]. 包装工程,2020,41(9):51−58. [49] Li N, Wang Y Z, Xu K J, et al. Development of green betaine-based deep eutectic solvent aqueous two-phase system for the extraction of protein[J]. Talanta,2016,152:23−32. doi: 10.1016/j.talanta.2016.01.042
[50] Damalas C A, Eleftherohorinos I G. Pesticide exposure, safety issues, and risk assessment indicators[J]. Public Health,2011,8(5):1402−1419.
[51] Ostovan A, Ghaedi M, Arabi M, et al. Hydrophilic multi-template molecularly imprinted biopolymers based on a green synthesis strategy for determination of B-family vitamins[J]. ACS Applied Materials & Interfaces,2018,10(4):4140−4150.
[52] Heidari H, Ghanbari-rad S, Habibi E. Optimization deep eutectic solvent-based ultrasound-assisted liquid-liquid microextraction by using the desirability function approach for extraction and preconcentration of organophosphorus pesticides from fruit juice samples[J]. Journal of Food Composition and Analysis,2020,87:103389. doi: 10.1016/j.jfca.2019.103389
[53] Ji Y H, Meng Z R, Zhao J, et al. Eco-friendly ultrasonic assisted liquid–liquid microextraction method based on hydrophobic deep eutectic solvent for the determination of sulfonamides in fruit juices[J]. Journal of Chromatography A,2020,1609:460520. doi: 10.1016/j.chroma.2019.460520
[54] Zhao J, Meng Z R, Zhao Z X, et al. Ultrasound-assisted deep eutectic solvent as green and efficient media combined with functionalized magnetic multi-walled carbon nanotubes as solid-phase extraction to determine pesticide residues in food products[J]. Food Chemistry,2019,310:125863.
[55] Ayazi Z, Jaafarzadeh R. Graphene oxide/polyamide nanocomposite as a novel stir bar coating for sorptive extraction of organophosphorous pesticides in fruit juice and vegetable samples[J]. Chromatographia,2017,80(9):1411−1422. doi: 10.1007/s10337-017-3364-5
[56] Peyrovi M, Hadjmohammadi M. Alkanol-based supramolecular solvent microextraction of organophosphorus pesticides and their determination using high-performance liquid chromatography[J]. Journal of the Iranian Chemical Society,2017,14(5):995−1004. doi: 10.1007/s13738-017-1049-5
[57] Hadjmohammadi M R, Peyrovi M, Biparva P. Comparison of C18silica and multi-walled carbon nanotubes as the adsorbents for the solid-phase extraction of chlorpyrifos and phosalone in water samples using HPLC[J]. Journal of Separation Science,2010,33(8):1044−1051. doi: 10.1002/jssc.200900494
[58] Bedendo G C, Jardim I C S F, Carasek E. Multiresidue determination of pesticides in industrial and fresh orange juice by hollow fiber microporous membrane liquid–liquid extraction and detection by liquid chromatography–electrospray-tandem mass spectrometry[J]. Talanta,2012,88:573−580. doi: 10.1016/j.talanta.2011.11.037
[59] Wang Y, Wang Z, Zhang H, et al. Application of pneumatic nebulization single-drop microextraction for the determination of organophosphorous pesticides by gas chromatography–mass spectrometry[J]. Journal of Separation Science,2011,34(15):1880−1885. doi: 10.1002/jssc.201100230
[60] Farajzadeh M A, Asghari A, Feriduni B. An efficient, rapid and microwave-accelerated dispersive liquid–liquid microextraction method for extraction and pre-concentration of some organophosphorus pesticide residues from aqueous samples[J]. Journal of Food Composition & Analysis,2016,48:78−80.
[61] He L, Luo X, Xie H, et al. Ionic liquid-based dispersive liquid–liquid microextraction followed high-performance liquid chromatography for the determination of organophosphorus pesticides in water sample[J]. Journal of Chromatography A,2009,655:52−59.
[62] Huertas-Pérez, José Fernando, Arroyo-Manzanares N, et al. Method optimization and validation for the determination of eight sulfonamides in chicken muscle and eggs by modified QuEChERS and liquid chromatography with fluorescence detection[J]. Journal of Pharmaceutical & Biomedical Analysis,2016,124:261−266.
[63] Mitrowska K, Antczak M. Determination of sulfonamides in beeswax by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B,2015,1006:179−186. doi: 10.1016/j.jchromb.2015.10.040
[64] Premarathne J M K J K, Satharasinghe D A, Gunasena A R C, et al. Establishment of a method to detect sulfonamide residues in chicken meat and eggs by high-performance liquid chromatography[J]. Food Control,2015,72:276−282.
[65] Wang Y, Liu L, Xiao C, et al. Rapid determination of trace sulfonamides in milk by graphene oxide-based magnetic solid phase extraction coupled with HPLC–MS/MS[J]. Food Analytical Methods,2016,9(9):2521−2530. doi: 10.1007/s12161-016-0433-6
[66] 郭美娟, 刘晓光, 史国华, 等. 食品中人工食用色素安全性[J]. 食品工业,2020,41(3):332−336. [67] Kanberoglu G S, Yilmaz E, Soylak M. Developing a new and simple ultrasound-assisted emulsification liquid phase microextraction method built upon deep eutectic solvents for Patent blue V in syrup and water samples[J]. Microchemical Journal,2019,145:813−818. doi: 10.1016/j.microc.2018.11.053
-
期刊类型引用(3)
1. 李巧莲,罗景阳,周长民,王岩松,袁帅,李娇,刘鑫,张承昕. 超高效液相色谱-四级杆/静电场轨道阱高分辨质谱法测定6种水果和蔬菜中41种农药残留. 中国食品添加剂. 2025(02): 143-153 .  百度学术
百度学术
2. 李巧莲,王岩松,罗景阳,宣彤. 液相色谱串联三重四极杆复合线性离子阱质谱法测定水果和蔬菜中43种杀菌剂残留量. 食品与机械. 2024(07): 53-62 .  百度学术
百度学术
3. 扈斌,蒋康丽,连思雨,崔宗岩,范春林,王明林,陈辉,连玉晶,吕美玲,王雯雯. 自动QuEChERS结合液相色谱-串联质谱法测定香叶中的212种农药残留. 食品安全质量检测学报. 2022(04): 1114-1122 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



