Determination of Arsanilic acid and Roxarsone Residues in Eggs by QuEChERS kit -High Performance Liquid Chromatography
-
摘要: 建立QuEChERS试剂盒联用高效液相色谱检测鸡蛋中阿散酸和洛克沙砷的方法。样品经混匀后用乙腈与10%三氟乙酸的甲醇溶液(1:1,V/V)萃取,离心,取上清液于QuEChERS净化管(内含净化填料400 mg PSA、400 mg C18 EC、45 mg GCB、1199 mg MgSO4)中净化萃取液,之后于高效液相色谱进行检测。结果表明,阿散酸和洛克沙砷在1.00~100.00 mg/L之间呈现良好线性关系,相关系数均大于0.999;方法检出限分别为0.044、0.063 mg/kg;定量限分别为0.149、0.211 mg/kg,阿散酸回收率在92.32%~95.95%,相对标准偏差1.54%~4.92%;洛克沙砷回收率是89.84%~94.91%,相对标准偏差2.19%~5.87%。本方法准确度高、精密度好、简便、快速,适用于鸡蛋中有机砷类兽药残留的检测,该研究为动物源性食品中禁用有机砷制剂的痕量分析奠定了方法基础。
-
关键词:
- QuEChERS试剂盒 /
- 高效液相色谱(HPLC) /
- 阿散酸 /
- 洛克沙砷 /
- 鸡蛋
Abstract: The method of using QuEChERS kit in combination with high performance liquid chromatography for determination of arsanilic acid and roxarsone in eggs was established. The sample was mixed and extracted with methanol solution (1:1, V/V) of acetonitrile and 10% trifluoroacetic acid, centrifuged, and the supernatant was taken and purified in QuEChERS purification tube (containing purification packing 400 mg PSA, 400 mg C18 EC, 45 mg GCB, 1199 mg MgSO4), and then detected by HPLC.The results showed that there was a good linear relationship between arsanilic acid and roxarsone in the range of 1.00~100.00 mg/L, and the correlation coefficients were all greater than 0.999.The detection limits were 0.044 and 0.063 mg/kg, respectively.The quantitative limits were 0.149 and 0.211 mg/kg, respectively. The recovery rate of arsanilic acid was 92.32%~95.95%, and the relative standard deviation was 1.54%~4.92%. The recovery rate of roxarsone were 89.84%~94.91%, and the relative standard deviation was 2.19%~5.87%.The method has high accuracy, good precision, simple and rapid, and is suitable for the determination of organoarsenic veterinary drug residues in eggs.This study provides a method basis for trace analysis of banned organic arsenic preparations in animal-derived foods.-
Keywords:
- QuEChERS kit /
- high performance liquid chromatography(HPLC) /
- arsanilic acid /
- roxarsone /
- eggs
-
阿散酸(arsanilic acid,ASA)和洛克沙砷(roxarsone,ROX)等有机砷制剂被广泛应用于畜禽生产中,其添加目的为促进生物生长,并提高饲料的利用率[1-2]。由于动物长期食用添加ASA和ROX的饲料,导致生物体内器官及组织中会残留有机砷类物质,并通过食物链的作用对人体生理机能造成不同程度的破坏[3-5]。我国于2017年7月31日发布停止使用ASA和ROX作为饲料添加剂的公告,但目前对二者的研究主要集中在饲料、肉类食品中,例如SaucedoVelez等[6]利用微波辅助萃取技术联合高效液相色谱法对牲畜饲料中ASA、ROX及硝苯砷酸进行痕量测定;王莹等[7]采用高效液相色谱串联质谱技术分析鸡肉中ROX残留量及其代谢物残留规律,而对蛋类的研究则较少,因此有必要建立定量检测鸡蛋中的ASA和ROX的方法,为完善动物源性食品中有害物质的分析标准提供技术支持。
近些年,常用于食品中有机砷制剂的萃取方法有固相萃取法(solid phase extraction,SPE)[8-9]、超声波辅助萃取法[10-11]、加速溶剂萃取法[12-14]等,然而这些萃取方法或操作繁琐或耗时较长,不适用于检测大批量的样品。2003年,Anastassiades等[15]首次建立了QuEChERS(Quick, Easy, Cheap, Effective, Rugged, Safe)前处理方法用于果蔬中农药残留的检测,该方法简便、高效、安全,耗时较短且减少了有机溶剂使用量,近几年被广泛应用于动物源性食品中兽药的残留分析[16]。
本试验拟采用QuEChERS的前处理方法,联合高效液相色谱技术(high performance liquid chromatography,HPLC)定量分析鸡蛋中痕量的ASA和ROX,以期为动物源性食品中有机砷类兽药残留提供理论依据。
1. 材料与方法
1.1 材料与仪器
甲醇、乙腈、三氟乙酸 均为色谱纯,上海安谱实验科技股份有限公司;ASA、ROX 纯度≥99%,上海楚定分析仪器有限公司;多壁碳纳米管 纯度≥97%,中国科学院成都有机化学有限公司;QuEChERS分散固相萃取净化试剂盒(型号:5982-5022,内含净化填料400 mg PSA、400 mg C18 EC、45 mg GCB、1199 mg MgSO4) 美国Agilent公司;QuEChERS萃取试剂盒(型号:5982-5058,配有袋装萃取填料MgSO4、NaCl) 美国Agilent公司;DIKMA ProElut C18填料 北京迪科马科技有限公司;弗罗里硅土、氧化铝填料 北京迈瑞达科技有限公司;Waters Oasis MAX固相萃取柱(规格:3cc/60 mg) 上海楚定分析仪器有限公司。
1525型高效液相色谱仪,配有2998光电二极管阵列检测器 美国Waters公司;ZORBAX Eclipse Plus C18液相色谱柱(1.8 μm,2.1 mm×50 mm)、Agilent 6460型串联三重四极杆质谱,配Agilent1290型液相色谱仪 美国Agilent公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;HGC-12A型氮吹仪 恒奥科技发展有限公司;MX-S型涡旋仪 美国SCILOGEX公司;Mill Q超纯水系统 美国Millipore公司;KQ5200E型超声波清洗器 昆山市超声仪器有限公司;AUY120/220型电子天平 日本岛津科技有限公司;FG-12型固相萃取仪器 天津市富城达科技有限公司;SHZ-111循环水真空泵 上海知信实验仪器技术有限公司。
1.2 实验方法
1.2.1 标准溶液制备
分别称取2.5 mg(精确到0.1 mg)ASA、ROX标准品至25 mL容量瓶中,甲醇定容,配制成100 mg/L的标准储备液,避光保存。将标准储备液用甲醇稀释成1.00、5.00、10.00、50.00、100.00 mg/L的系列标准工作溶液待用。
1.2.2 样品前处理
1.2.2.1 SPE法
取0.5 g(精确到0.1 mg)鸡蛋样品置于50 mL离心管中,加入10 mL甲醇与5%三氟乙酸水溶液(9:1,V/V),涡旋5 min,10000 r/min离心5 min,将上清液转移至10 mL离心管中,残渣中再加入提取液5 mL,重复上述步骤,合并上清液,经旋蒸至剩余5 mL,再分别用C18柱、MAX柱和填充多壁碳纳米管柱对ASA、ROX进行净化。试验中SPE装置净化步骤: 取5 mL甲醇活化0.5 g(精确到0.1 mg)固相萃取小柱;5 mL上清液进行上样;5 mL甲醇与水(1:1,V/V)淋洗杂质;采用优化的洗脱剂甲醇与甲酸(60:40 ,V/V)5 mL进行洗脱,收集洗脱液,流速控制为1 mL/min。30 ℃用氮吹吹至1 mL以下,用甲醇定容至1 mL,过0.45 μm有机滤膜,供HPLC检测。
1.2.2.2 基质固相分散萃取法(matrix solid phase dispersion extraction,MSPDE)
向玛瑙研钵中准确加入0.5 g(精确到0.1 mg)加标样品,分别用0.5 g(精确到0.1 mg)弗罗里硅土与0.5 g(精确到0.1 mg)中性氧化铝填料进行净化,充分研磨5 min,使样品与填料完全混匀,并将混合物转移至萃取柱中。用甲醇与甲酸(60:40,V/V)作洗脱剂,在重力作用下对目标物进行洗脱,随后用10 mL离心管收集洗脱液。收集3 mL后,30 ℃氮吹吹至1 mL以下,甲醇定容至1 mL,过0.45 μm有机滤膜,进行色谱分析。
1.2.2.3 QuEChERS试剂盒法
取0.5 g(精确到0.1 mg)鸡蛋匀浆于50 mLQuEChERS萃取管(配有袋装萃取填料MgSO4、NaCl)中,加入15 mL乙腈与10%三氟乙酸的甲醇溶液(1:1,V/V),涡旋5 min,再加入QuEChERS试剂盒的提取填料,10000 r/min离心5 min,移取上层液(约5 mL)于QuEChERS净化管(内含净化填料400 mg PSA、400 mg C18 EC、45 mg GCB、1199 mg MgSO4)中,涡旋5 min,10000 r/min离心5 min,移取上清液于氮吹管中,氮气吹至1 mL以下,甲醇定容至1 mL,过0.45 μm有机滤膜,得待测样品。
1.2.3 HPLC检测条件
Agilent ZORBAX Eclipse Plus C18液相色谱柱(1.8 μm,2.1 mm×50 mm),柱温20 ℃,进样量:10 μL。检测波长为260 nm。流动相为甲醇与0.1%三氟乙酸水溶液(30:70,V/V),等度洗脱。
1.2.4 UPLC-MS/MS检测条件
色谱条件:流动相为0.1%三氟乙酸水溶液(A)与 甲醇(B),等度洗脱泵A与泵B(70:30,V/V),流速为0.2 mL/min,进样量2 μL。质谱条件:电喷雾电离源(ESI),负离子扫描,锥孔电压40 V,毛细管电压3.5 kV,脱溶剂气温度350℃。采用多反应监测扫描模式(MRM),ASA定性离子为m/z 123.03,碰撞能量16 V,及m/z 107.16,碰撞能量为34 V;ROX定性离子为m/z 123.26,碰撞能量为25 V,及m/z 153.07,碰撞能量34 V。
1.2.5 方法学评价
1.2.5.1 方法的线性范围、检出限和定量限
用ASA、ROX标准储备液配制浓度分别为1.00、5.00、10.00、50.00、100.00 mg/L的标准工作溶液,进样后制作标准曲线,方法在1.00~100.00 mg/L范围内线性良好。将加标浓度逐级稀释添加于样品中测定信噪比,以3倍噪音(RSN=3)确定检测限(LOD)、以10倍噪音(RSN=10)确定定量限(LOQ)。
1.2.5.2 回收率和精密度
以空白基质样品进行1.00、50.00、100.00 mg/L 3个水平的加标回收试验,重复测定6次,按建立的方法处理样品,测定并计算回收率和精密度。
1.2.6 实际鸡蛋样品测定
选择普通鸡蛋、柴鸡蛋做实际样品测定,分别采集了4份来源不同的鸡蛋样品进行测定。试验样品的来源分别是:普通鸡蛋1,河北省保定市农贸市场;普通鸡蛋2,河北省保定市大型超市;普通鸡蛋3,河北省保定市某养鸡场;普通鸡蛋4,河北省保定市某集市;柴鸡蛋1,河北省保定市某养鸡场;柴鸡蛋2,河北省保定市批发市场;柴鸡蛋3,河北省保定市大型超市;柴鸡蛋4,河北省保定市菜市场。
1.3 数据处理
利用Microsoft Excel 2019软件进行数据整理分析。采用Origin 2017制图软件作图。
2. 结果与分析
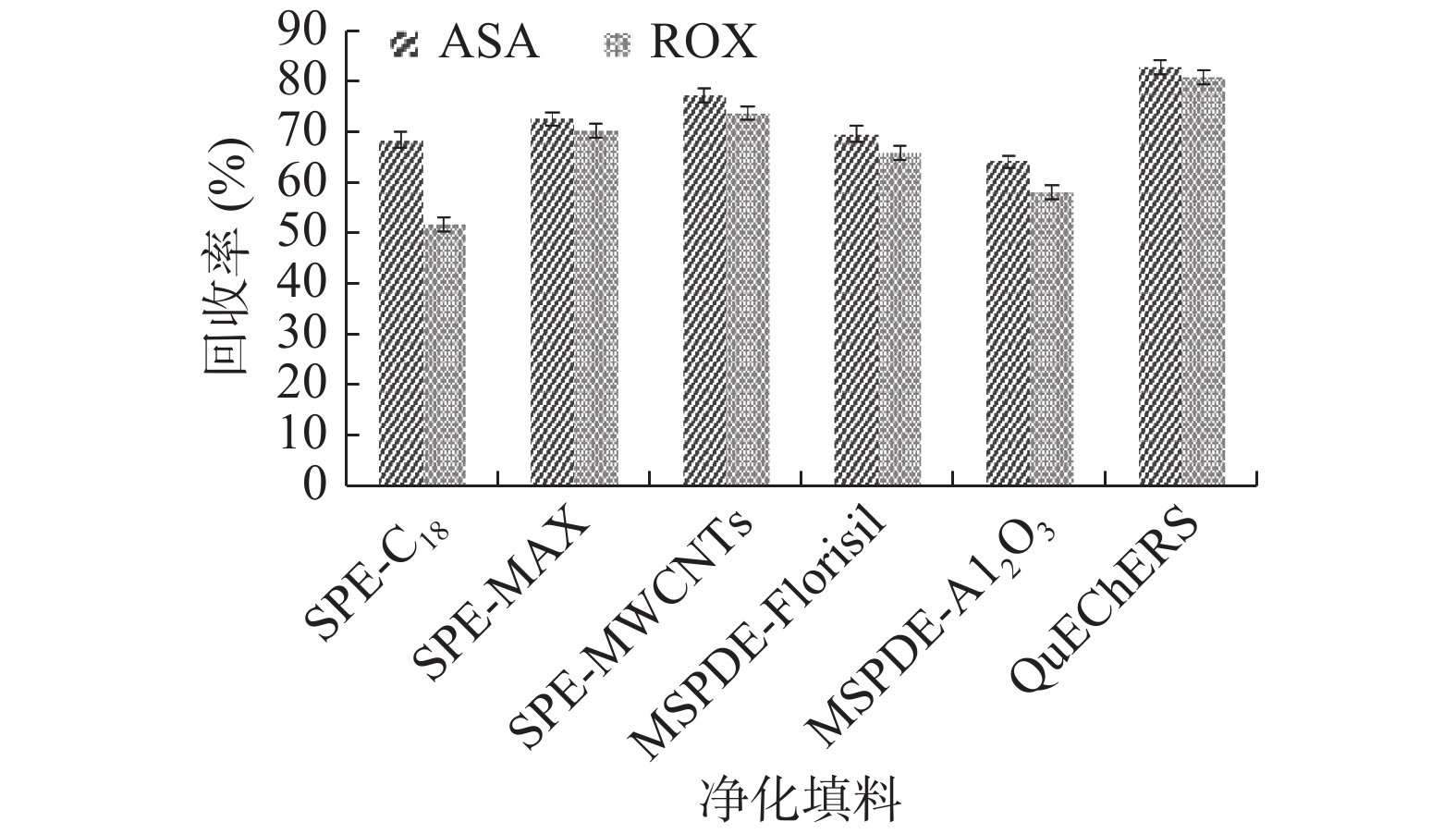
2.1 优化比较前处理方法
本试验首次比较了SPE法、MSPDE法及QuEChERS法中不同净化填料对目标有机砷制剂的净化效果,结果如图1所示。黄佳佳等[17]研究了多壁碳纳米管(MWCNTs)作为SPE填料对农兽药的吸附能力,结果表明其对极性化合物净化效果较好。故本试验比较了C18、MAX[9]和MWCNTs填料对目标有机砷制剂的净化效果,结果表明,C18对两种极性化合物吸附效果差,其具有较强疏水性;MAX填料吸附效果较好,但不易将目标物洗脱下来,操作繁琐;MWCNTs填料净化能力明显优于其它填料,由于其比表面积大,吸附能力较强,对于极性有机化合物有较高富集能力[18],但在目标化合物附近易存在一定程度的色谱峰干扰,且回收率低于QuEChERS法。
在MSPDE法中,分别优化比较弗罗里硅土(Florisil)与中性氧化铝填料[19]净化效果,二者均为强极性吸附剂,对有机砷制剂有一定吸附能力。结果表明,添加Florisil对ASA、ROX的色谱图响应值较高。但采用优化的Florisil净化样品时,洗脱液有较多杂质,柱净化难度较大,除杂能力较弱。
QuEChERS法应用QuEChERS试剂盒进行样品提取净化,操作简单,省略了SPE中淋洗、洗脱等步骤,减少了分析物在转移过程的损失,且前处理快速;同时该法相比于MSPDE法杂质干扰小,净化萃取柱中含有的PSA、GCB等组合填料有效去除了鸡蛋样品中蛋白、磷脂以及色素等干扰物质,显著降低了基质效应。故本试验选择QuEChERS法进行前处理操作。姜涛等[20]利用微波辅助萃取法分析测定鸡蛋中ASA、ROX含量,但该仪器成本较贵,且试验所需优化影响因素较多,操作较繁琐,本试验中QuEChERS法装置简单成本较低,无需复杂操作且准确度较高。
净化效果越好,基质对目标化合物的干扰越小。由图1可知,3种方法对于同一加标浓度1 mg/L鸡蛋样品的净化效果,用QuEChERS法获得的响应值更高,并且在同一实验条件下目标物回收率均达到80%以上。为了使目标物回收率达到最佳,需对QuEChERS法进一步优化。
2.2 QuEChERS法条件的优化
2.2.1 萃取剂组成及浓度的优化
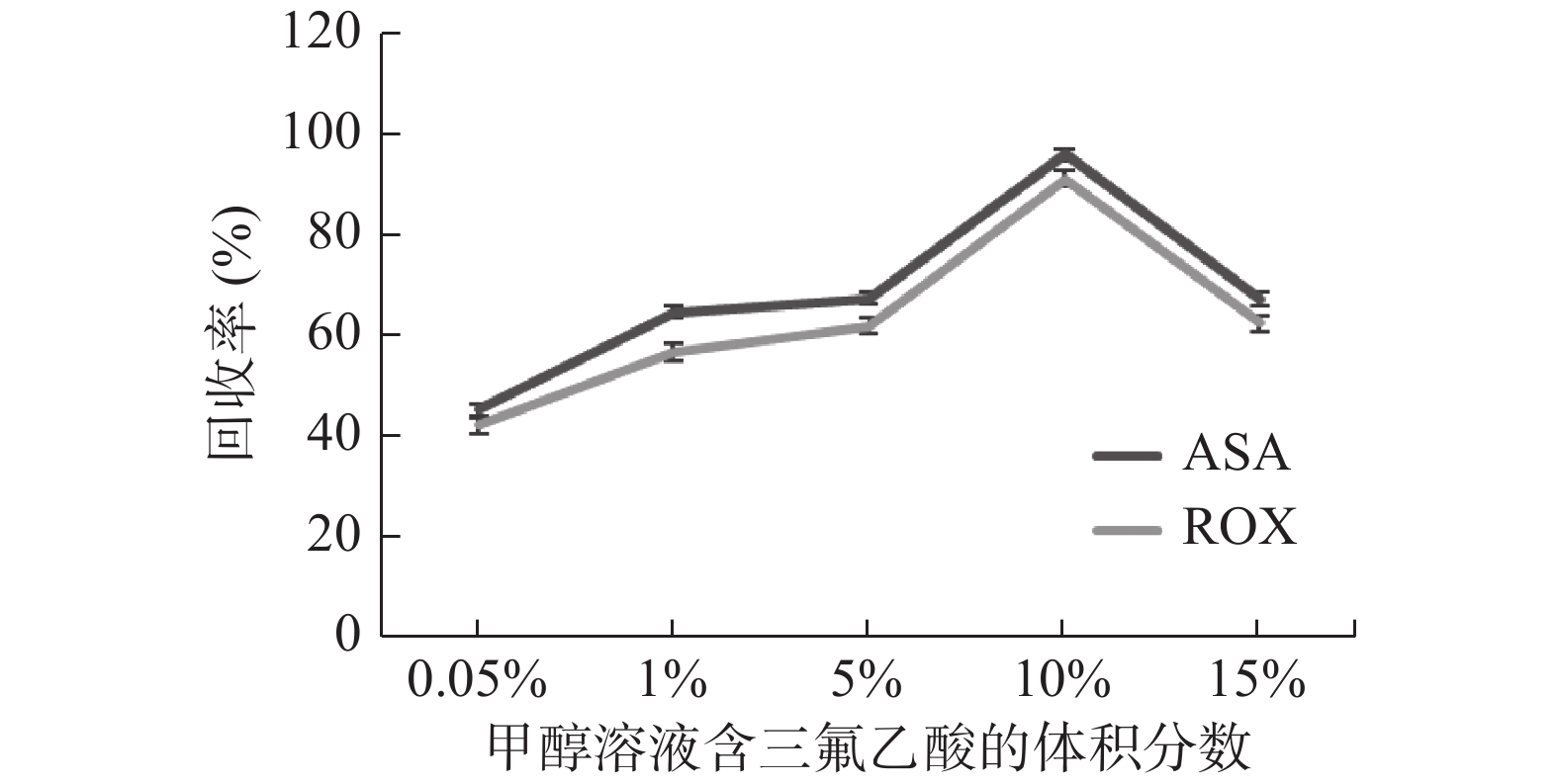
常见有机砷提取剂包括纯水、甲醇等单一有机溶剂或有机溶剂和水按一定比例的混合溶液。本试验在Eom等[21]研究的基础上,在同一提取比例下对不同萃取剂组成的乙腈、甲醇、水混合提取液进行优化试验,乙腈与甲醇组合时提取液较澄清,但由于鸡蛋样品中蛋白质含量较高,而酸性条件下有利于蛋白质沉淀,因此选择含三氟乙酸的甲醇溶液沉淀蛋白,并优化含三氟乙酸体积分数分别为0.05%、1%、5%、10%、15%的甲醇溶液对蛋白质沉淀和目标物萃取效率的影响(图2)。结果表明,当采用乙腈与10%三氟乙酸的甲醇混合溶液时提取效率较好,ASA、ROX的回收率均达到91%以上。
2.2.2 萃取剂比例的选择
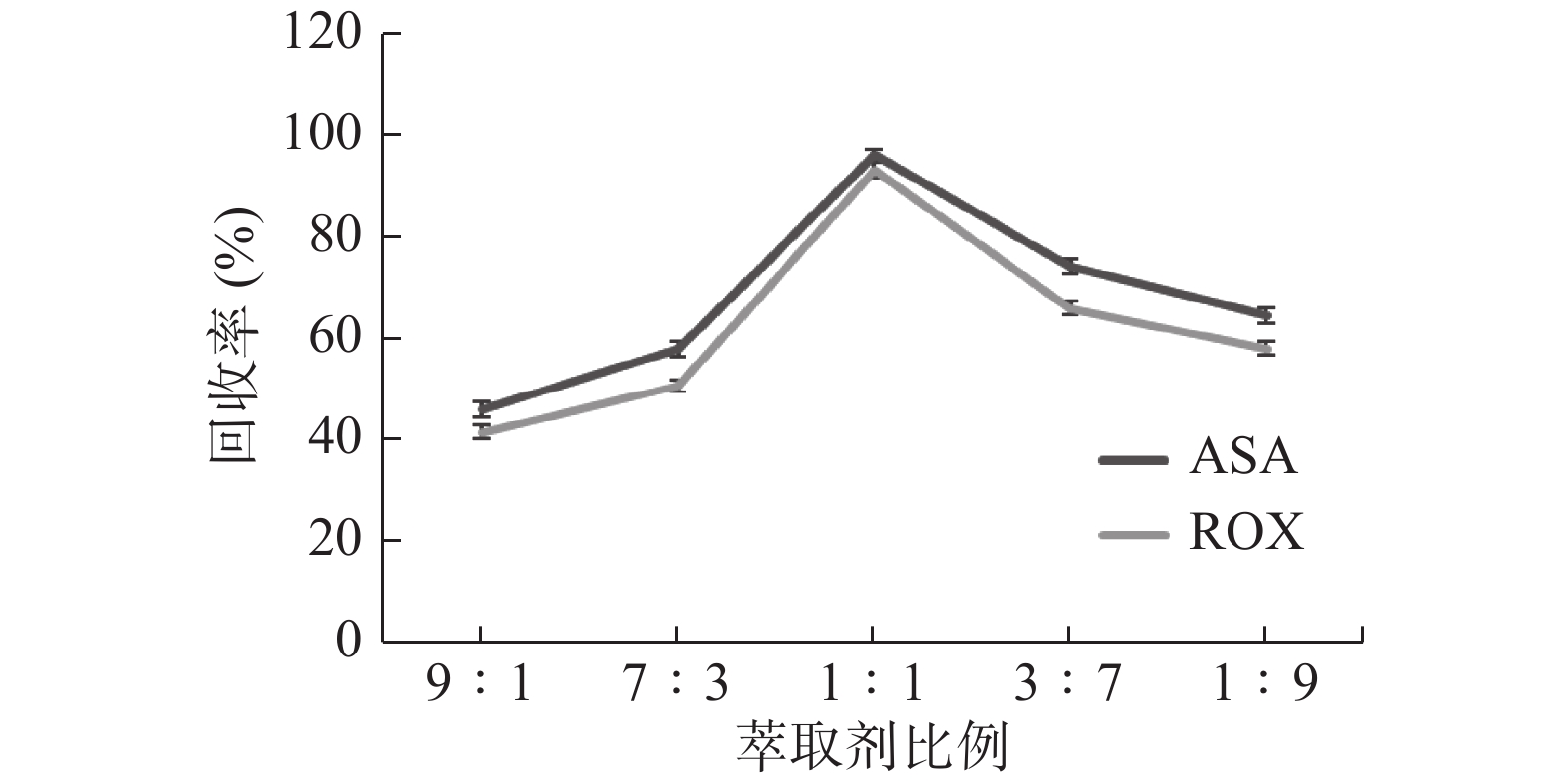
肖亚兵等[12]研究表明提取剂比例影响有机砷制剂的提取效率,故为保证萃取完全,试验比较了不同比例的萃取剂,如图3所示,乙腈与10%三氟乙酸的甲醇溶液(1:1,V/V)时,可最大程度地从鸡蛋样品中提取出ASA、ROX,且基质干扰较小。试验还比较提取次数对萃取率的影响,发现提取次数过多时,萃取率反而下降,可能是由于有机砷类物质与基质相互作用,导致目标物有所损失,故试验选择了一次提取。在采用优化的萃取剂比例下,两种目标物的回收率均达到了93%以上。
2.3 HPLC条件的优化
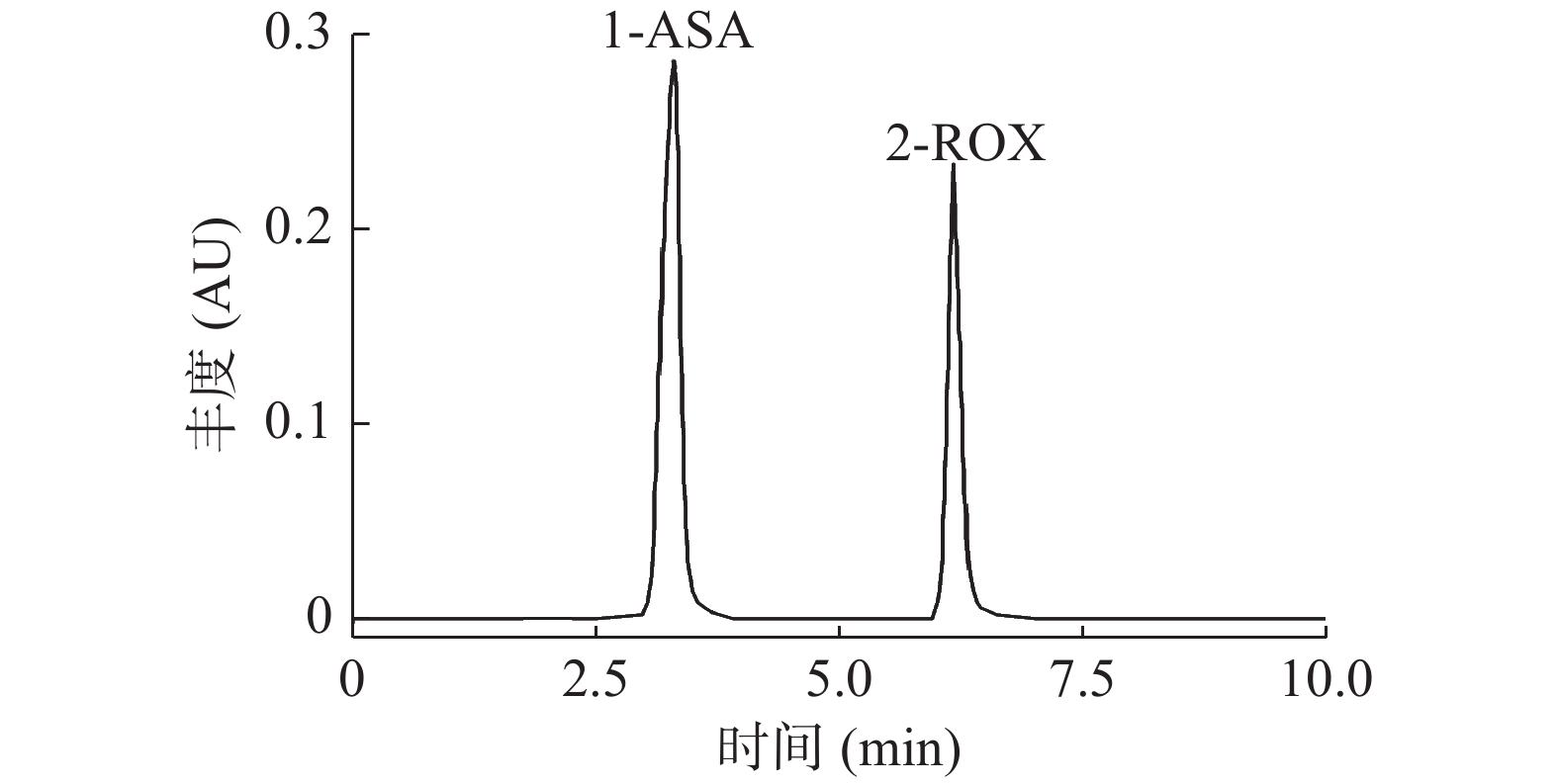
通过二极管阵列检测器对ASA、ROX混合标准溶液进行全波长扫描,试验表明在260 nm处ASA、ROX有较强吸收。并采用Waters Atlantis T3 5 μm色谱柱对目标物质ASA、ROX进行分离。当只采用甲醇与水时,ASA出峰时间延后,且峰的锐度不好。杨丽君等[22]研究表明在流动相中添加一定量的三氟乙酸,有效缩短出峰时间,改善峰型。因此本实验中优化比较了甲醇分别与体积分数为0.01%、0.05%、0.1%、0.15%、0.2%的三氟乙酸水溶液作为流动相时目标物的出峰情况,最终采用甲醇与0.1%三氟乙酸水溶液(30:70,V/V),在10 min内实现两种目标物的良好分离,ASA、ROX保留时间分别为3.298、6.174 min,柱效较高,峰型尖锐对称,基线平稳,无杂峰干扰(如图4)。
2.4 UPLC-MS/MS条件的优化
为了丰富检测ASA、ROX的仪器方法,试验中还利用了UPLC-MS/MS对样品进行测定。流动相中的三氟乙酸可以改善峰型,并且有助于提高质谱负离子扫描时的离子化效率,故同样使用甲醇与0.1%三氟乙酸水溶液(30:70,V/V)作为流动相,等度洗脱,提高柱温对分离无明显效果,故确定现有色谱条件。
为提高分析灵敏度,选用MRM进行检测,同时对ASA、ROX进行定性离子通道分析,使定性更为准确;两种有机砷物质呈弱酸性且易失质子,质谱条件选择负离子模式,并采用电喷雾离子源,明显降低离子干扰[23]。试验还对喷雾电压、碰撞能量及离子源温度等参数进行了优化,进而提高方法准确性。结果表明,在优化条件下,以3倍噪音(RSN=3)确定LOD、以10倍噪音(RSN=10)确定LOQ。ASA的LOD为0.122 μg/kg,LOQ为0.372 μg/kg;ROX的LOD为0.254 μg/kg,LOQ为0.760 μg/kg。该方法检测限低、灵敏度高,但检测成本昂贵,且检测周期较长,不利于向中小型企业或检测机构推广。为了降低成本及考虑到方法的实用性,本试验使用HPLC技术分析检测两种目标物。
2.5 方法学评价
2.5.1 方法的线性范围、检出限和定量限
将ASA、ROX混合标准储备液用甲醇稀释成浓度为1.00、5.00、10.00、50.00、100.00 mg/L的系列标准液,每个浓度重复测定5次。以色谱峰面积(Y)为纵坐标,ASA、ROX浓度(X)为横坐标绘制标准曲线。在HPLC最佳检测条件下,ASA线性方程为y=3.59×104 x+1.33×105,R=0.999831;ROX线性方程为y=2.23×104x+6.59×103,R=0.999562,在线性范围1.00~100.00 mg/L线性关系良好。根据1.2.2样品前处理方法,以3倍噪音(RSN=3)确定LOD、以10倍噪音(RSN=10)确定LOQ。ASA、ROX的LOD分别为0.044、0.063 mg/kg;LOQ分别为0.149、0.211 mg/kg。试验还比较了近几年不同分析方法的灵敏度,见表1。
表 1 不同方法灵敏度的比较Table 1. Sensitivity comparison of different methods2.5.2 回收率和精密度
以空白基质样品进行3个水平的加标回收试验,重复测定6次,按建立的方法处理样品,测定并计算回收率和精密度见表2。结果如下:ASA的回收率92.32%~95.95%,相对标准偏差1.54%~4.92%;ROX回收率89.84%~94.91%,相对标准偏差2.19%~5.87%。加标鸡蛋样品的HPLC图见图4。
表 2 样品加标回收率及精密度Table 2. Recovery and precision of standardized samples化合物 加标浓度(mg/L) 加标回收率(%) 相对标准偏差(%) ASA 1.00 92.32 1.54 50.00 95.13 4.63 100.00 95.95 4.92 ROX 1.00 90.16 2.19 50.00 89.84 5.87 100.00 94.91 4.73 2.6 实际鸡蛋样品测定
检测了普通鸡蛋和柴鸡蛋中ASA和ROX的含量,分别采集了4份来源不同的样品进行分析。试验中实际鸡蛋样品采集自私人养鸡场、农贸市场、菜市场、超市、批发市场和集市上,采集地点养鸡场、市场可能存在缺乏监管的现象,生产的鸡蛋会残留有ASA、ROX等饲料添加剂的问题,但按照建立的方法制备样品,经HPLC分析,均未有ASA、ROX检出(表3)。结果表明市售的鸡蛋不会对消费者构成危害。
表 3 实际样品测定(mg/kg)Table 3. Actual sample determination(mg/kg)样品 ASA含量 ROX含量 样品 ASA含量 ROX含量 柴鸡蛋1 ND ND 普通鸡蛋1 ND ND 柴鸡蛋2 ND ND 普通鸡蛋2 ND ND 柴鸡蛋3 ND ND 普通鸡蛋3 ND ND 柴鸡蛋4 ND ND 普通鸡蛋4 ND ND 注:“ND”表示未检出。 3. 结论
采用QuEChERS试剂盒,联合高效液相色谱法检测鸡蛋样品中ASA、ROX的残留含量。该方法高效、快速、简便,具有良好的稳定性和精密度。方法检出限ASA、ROX分别为0.044、0.063 mg/kg;定量限分别为0.149、0.211 mg/kg;相对标准偏差1.54%~5.87%之间。本试验采用的液相色谱法适用性广,检测成本低,且不受样品挥发性和热稳定性的限制[24-25],分析速度快,可应用于其它动物源性食品中ASA和ROX的检测。
-
表 1 不同方法灵敏度的比较
Table 1 Sensitivity comparison of different methods
表 2 样品加标回收率及精密度
Table 2 Recovery and precision of standardized samples
化合物 加标浓度(mg/L) 加标回收率(%) 相对标准偏差(%) ASA 1.00 92.32 1.54 50.00 95.13 4.63 100.00 95.95 4.92 ROX 1.00 90.16 2.19 50.00 89.84 5.87 100.00 94.91 4.73 表 3 实际样品测定(mg/kg)
Table 3 Actual sample determination(mg/kg)
样品 ASA含量 ROX含量 样品 ASA含量 ROX含量 柴鸡蛋1 ND ND 普通鸡蛋1 ND ND 柴鸡蛋2 ND ND 普通鸡蛋2 ND ND 柴鸡蛋3 ND ND 普通鸡蛋3 ND ND 柴鸡蛋4 ND ND 普通鸡蛋4 ND ND 注:“ND”表示未检出。 -
[1] Erickson R J, Mount D R, Highland T L, et al. The effects of arsenic speciation on accumulation and toxicity of dietborne arsenic exposures to rainbow trout[J]. Aquatic Toxicology,2019,210:227−241. doi: 10.1016/j.aquatox.2019.03.001
[2] Sun T, Zhao Z, Liang Z, et al. Efficient degradation of p-arsanilic acid with arsenic adsorption by magnetic CuO-Fe3O4 nanoparticles under visible light irradiation[J]. Chemical Engineering Journal,2018,334:1527−1536. doi: 10.1016/j.cej.2017.11.052
[3] Chen K, Ji F, Yuan S, et al. Performance of activated sludge exposed to arsanilic acid and amprolium hydrochloride in sequencing batch reactors[J]. International Biodeterioration & Biodegradation,2017,116:260−265.
[4] Yao L, Carey M P, Zhong J, et al. Soil attribute regulates assimilation of roxarsone metabolites by rice (Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety,2019,184:109−113.
[5] 宋琳. 饲料中有机砷的含量及危害概述[J]. 当代畜牧,2016(26):125−126. [6] Saucedovelez A A, Hinojosareyes L, VillanuevaRodríguez M, et al. Speciation analysis of organoarsenic compounds in livestock feed by microwave-assisted extraction and high performance liquid chromatography coupled to atomic fluorescence spectrometry.[J]. Food Chemistry,2017,232:493−500. doi: 10.1016/j.foodchem.2017.04.012
[7] 王莹, 田亚平, 陈洋, 等. 高效液相质谱联用法测定鸡肉中洛克沙胂[J]. 畜牧与兽医,2017,49(4):58−60. [8] Chen D, Zhang H, Tao Y, et al. Development of a high-performance liquid chromatography method for the simultaneous quantification of four organoarsenic compounds in the feeds of swine and chicken[J]. Journal of Chromatography B,2011,879(11-12):716−720. doi: 10.1016/j.jchromb.2011.02.013
[9] 肖亚兵, 韦玮, 高健会, 等. 固相萃取/高效液相色谱法对饲料中阿散酸、硝苯砷酸和洛克沙砷的同时测定[J]. 分析测试学报,2008,27(9):964−967. doi: 10.3969/j.issn.1004-4957.2008.09.013 [10] Wang W X, Yang T J, Li Z G, et al. A novel method of ultrasound-assisted dispersive liquid–liquid microextraction coupled to liquid chromatography–mass spectrometry for the determination of trace organoarsenic compounds in edible oil[J]. Analytica Chimica Acta,2011,690(2):221−227. doi: 10.1016/j.aca.2011.02.033
[11] Liu Q. Enzyme-assisted extraction and liquid chromatography mass spectrometry for the determination of arsenic species in chicken meat[J]. Analytica Chimica Acta,2015,888:1−9. doi: 10.1016/j.aca.2015.05.001
[12] 肖亚兵, 张曼, 温华蔚. 加速溶剂萃取-液相色谱-原子荧光法同时测定动物源性食品中阿散酸、硝苯砷酸与洛克沙砷的残留量[J]. 光谱学与光谱分析,2014,34(4):1100−1103. doi: 10.3964/j.issn.1000-0593(2014)04-1100-04 [13] Cui J, Xiao Y B, Dai L, et al. Speciation of Organoarsenic species in food of animal origin using accelerated solvent extraction (ASE) with determination by HPLC-hydride generation-atomic fluorescence spectrometry (HG-AFS)[J]. Food Analytical Methods,2013,6(2):370−379. doi: 10.1007/s12161-012-9533-0
[14] Sun H, Ge X, Lv Y, et al. Application of accelerated solvent extraction in the analysis of organic contaminants, bioactive and nutritional compounds in food and feed[J]. Journal of Chromatography A,2012,1237:1−23. doi: 10.1016/j.chroma.2012.03.003
[15] Anastassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. Journal of Aoac International,2003,86(2):412−431. doi: 10.1093/jaoac/86.2.412
[16] 陈涛, 倪建秀, 丁春晖, 等. 应用QuEChERS方法检测动物源性食品中药物残留的研究进展[J]. 现代食品,2020(1):22−24. [17] 黄佳佳, 江东文, 杨昭, 等. 多壁碳纳米管固相萃取技术及其在食品安全检测中的应用[J]. 食品工业科技,2016,37(14):368−374. [18] Ki-Seok Kim, Soo-Jin Park. Influence of multi-walled carbon nanotubes on the electrochemical performance of graphene nanocomposites for supercapacitor electrodes[J]. Electrochimica Acta,2010,56(3):1629−1635.
[19] 赵海香, 邓维, 尚艳芬, 等. 基于低毒溶剂的MSPD/HPLC法同时测定鱼肉中8种磺胺类药物残留[J]. 食品科学,2009,30(4):149−152. doi: 10.3321/j.issn:1002-6630.2009.04.029 [20] 姜涛, 崔颖, 倪松. MAE-LC-AFS测定鸡蛋中阿散酸、洛克沙砷、硝苯砷酸[J]. 食品研究与开发,2017,38(16):157−161. doi: 10.3969/j.issn.1005-6521.2017.16.035 [21] Eom H Y, Yang D H, Suh J H, et al. Determination of residual arsenic compounds in chicken muscle by ultra-performance liquid chromatography coupled with ultraviolet detection after pre-column derivatization with toluene-3, 4-dithiol[J]. Journal of Chromatography B,2015,1006:151−157. doi: 10.1016/j.jchromb.2015.10.034
[22] 杨丽君, 刘玉敏, 崔凤杰, 等. 高效液相色谱-电感耦合等离子体质谱同时分析鸡肉中洛克沙生、阿散酸和硝苯胂酸[J]. 食品科学,2011,32(18):202−204. [23] Chunhua Z, Wenhui D, Xiaoni W. UHPLC-MS/MS determination of arsanilic acid and roxarsone in feed[J]. Physical Testing and Chemical Analysis,2019,55(2):171−177.
[24] Fan J, Ding Z, Zhao Z, et al. Degradation of p-arsanilic acid and simultaneous in-situ removal of arsenic species with ferrate(VI): Kinetics, intermediate and degradation pathway[J]. Chemical Engineering Journal,2018,350:453−462. doi: 10.1016/j.cej.2018.04.144
[25] Zhao D, Wang J, Yin D, et al. Arsanilic acid contributes more to total arsenic than roxarsone in chicken meat from Chinese markets[J]. Journal of Hazardous Materials,2019,383:121−178.
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



